脱毛に悩むなら、まずは『Minoスカルプチェック』をお試しください
脱毛について調べると、よく「ミノキシジル」という薬が高く評価されていることに気付くかもしれません。しかし、実際に試す前に、自分の頭皮や脱毛のタイプに合った治療法を確認す方法があります。
脱毛が 一般的なAGA(男性型脱毛症) によるものであれば、まずは『Minoスカルプチェック』で適性を確認してみませんか?
AGAとは?
AGA(男性型脱毛症)は、すべての脱毛症の中で最も多く見られるタイプです。実は男性だけでなく、女性にも影響を及ぼすことがあり、女性の場合は「女性型脱毛症」と呼ばれることもあります。
発症率(世界統計):
- 男性:10万人あたり約50,000人
- 女性:10万人あたり約15,000人
AGAは特に男性に多く見られる一方、女性では閉経後に発症するケースが高い割合を占めています。AGAの治療は適切な診断が重要です。『Minoスカルプチェック』は、自宅で簡単にチェックできるサービスで、あなたの脱毛タイプや頭皮の状態を正確に把握するお手伝いをします。その結果に基づいて、最適な治療法を選ぶことができます。「脱毛が気になるけれど、どこから始めればいいのかわからない」と悩んでいる方は、ぜひ一度『Minoスカルプチェック』をお試しください。
| Androgenetic Alopecia (AGA) Andro + genetic, Alopec + ia |
||
|---|---|---|
| Androgen | 男性ホルモン | |
| Genetic | 遺伝子 | |
| Alṓp??x (ἀλ??πηξ , “fox”) | 狐 | 「alopekia(脱毛症)」はギリシャ語で「キツネ」を意味する言葉に由来し、毛がまばらに残る脱毛のことを指します。キツネなどに見られる疥癬のような状態です。 |
| -ia (-??α) | 病・症 | |
大きく分けて7つの主要な病因カテゴリーがありますが、一般的なリスク要因としては、ストレス、ホルモンバランスの乱れ、炎症、栄養不足、薬剤の副作用などが挙げられます。さらに、喫煙、飲酒、および父系遺伝も早期のAGA発症のリスク要因とされています。
ジーンチェッカー『Minoスカルプチェック』を選ぶ理由
ミノキシジルの治療効果を正確に評価するためには、最低12カ月間の使用が推奨されます。しかし、SULT1A1検査のジーンチェッカー『Minoスカルプチェック』を行うことで、費用、時間的な負担、そして効果が得られなかった場合の精神的ダメージを回避できる可能性があります。
ミノキシジル外用薬の効果と特徴
ミノキシジル外用薬は、終末毛の成長を促進する効果が数多くの臨床試験で証明されています。この薬は副作用が少なく、高い忍容性を持ち、安全に使用できる点が特徴です。また、入手が容易である一方、効果を得るためには長期間にわたる継続的な使用と一定の努力が必要です。その作用機序については、下記に述べています。
外用薬と経口薬の比較
ミノキシジル外用薬は、経口ミノキシジルやフィナステリド、デュタステリドといった一般的な代替薬よりも安全性が高いとされています。
外用薬はより制御された方法で使用でき、副作用は少なく、重篤な薬剤関連の有害反応はほとんど報告されていません。
一方、経口ミノキシジルは、用量に依存して以下のような副作用を引き起こすことがあります:
-
多毛症(患者の約5人に1人に発生):
- 0.25mg服用時:6.7%
- 5mg服用時:56.1%
- 心血管系の症状:体液貯留、頻脈、吐き気、心膜炎、倦怠感、呼吸困難、乳腺肥大
また、多毛症は、通常より過剰な体毛の増加を指し、全身に発生する場合や、顔や手など特定の部位に限局する場合があります。外用薬による顔面多毛症は非常に稀ですが、発生の可能性はあります。
他の薬剤との副作用の違い
経口ミノキシジルは主に多毛症や心血管系の症状を引き起こす一方、フィナステリドやデュタステリドは性機能障害や神経精神的副作用と関連しています。この点からも、外用ミノキシジルの使用はより安全性の高い選択肢と言えます。
長期使用と効果維持
大規模な臨床試験により、5%ミノキシジル外用液を男性が継続使用した場合、発毛効果が最長48週間持続することが確認されています。ただし、使用を中止すると、再生した髪は3〜4か月以内に再び抜け始める可能性があります。
現在、国内大手製薬会社が提供する5%ミノキシジル外用液は、30日分が¥8,140(2024年11月時点)で販売されています。これを10年間継続使用した場合、総額は約¥990,000に達します。
ミノキシジルの効果を実感するには、長期的かつ継続的な使用が必要です。また、発毛を維持するには使用を続けることが欠かせません。
さらに、使用開始直後には一時的に抜け毛が増加することがあります※。このため、事前に『ジーンチェッカー Minoスカルプチェック』を活用して、ミノキシジルの効果を引き出す酵素「SULT1A1」が頭皮で十分に機能しているかを確認することをお勧めします。このテストを行うことで、長期的な治療の成功率を高めるとともに、コストパフォーマンスを事前に見極めることが可能です。
※ミノキシジル溶液の使用を開始すると、最初の2週間ほどは一時的に抜け毛が増えることがあります。これは、古い毛が抜け落ちて新しい毛が生えてくる準備をしている良い兆候であり、ミノキシジル治療の正常なプロセスの一部です。この一時的な抜け毛は自然に収まるとされていますが、2週間以上続く場合は、医療専門家に相談されることをお勧めします。また、一部の方では、目に見える発毛効果が出るまでに少なくとも4か月間の継続使用が必要となる場合があります。
ジーンチェッカー『Minoスカルプチェック』
ジーンチェッカー『Minoスカルプチェック』は、ミノキシジルの効果を最大限に引き出す上で重要な酵素であるSULT1A1の量を測定するためのテストです。このテストの結果は、1週間以内に返却されます。
研究では、薄毛が始まってからミノキシジル外用薬を使用し始めるまでの時間が短いほど、優れた発毛効果が得られる可能性が高いことが確認されています。
こんな方にオススメ
- 最近、生え際の後退や薄毛の進行が気になり始めた方
- 将来的にミノキシジル治療を検討している方
これらに該当する方には、早期の治療が効果的です。また、ミノキシジルの効果を最大限に受ける事が出来るか、事前に『ジーンチェッカー Minoスカルプチェック』で適応性を確認することをお勧めします。
こんな方にオススメしない(ミノキシジル使用とSULT1A1の検査)
1. 長期的に治療を継続する予定がない方
ミノキシジルは継続使用が必要です。残念ながら、使用を中止すると、数か月後に新しく生えた髪はすべて抜け落ちてしまいます。
2. ホルモンバランスが髪の成長に影響を与える可能性のある方
以下の条件に該当する場合、効果に影響が出る可能性があります:
- 甲状腺の問題を抱えている方
- 断食中または栄養不良の方
- 妊娠中または産後の方(多くの人に産後一時的に部分的な脱毛が見られますが、これは正常であり、通常は時間とともに回復します)
これらの条件に該当する場合は、使用を開始する前に医療専門家と相談することをお勧めします。
検査の流れ
以下の注意事項をお読みいただき、手順を開始してください。必要に応じて、リンク先のビデオもご参照いただければ幸いです。
注意事項
毛根採取の24時間前までにお控えいただきたい事項:
-
ヘアケア製品の使用
- パラベンを含むヘアケア製品
- 亜鉛ピリチオン配合のフケ防止シャンプー
- ミノキシジル関連製品
- 髪の漂白やカラーリング
-
サリチル酸塩(Salicylate)を含む製品の使用
- フケ防止シャンプーなどのサリチル酸塩を含む製品の使用
- アスピリンの摂取
サリチル酸塩(抗フケシャンプーに含まれる成分)やアスピリンは、スルホトランスフェラーゼ(SULT1A1)の活性を阻害することが知られています。特に低用量アスピリンを摂取した場合、毛包の酵素活性は2週間後でも低下したままになることがあります。
毛根採取の効果を最大化するため、上記の製品や成分を避けることをお勧めします。
『Minoスカルプチェック』の使用方法
後頭部から10本の頭髪の毛根を採取する必要があります。最も速く、痛みの少ない最適な方法は以下のとおりです:
- 髪の毛を皮膚の表面にできるだけ近い場所でしっかりとつかんでください。必要に応じてピンセットをご使用ください。
- 一気に素早く、皮膚に対して垂直に引き抜きます。
- 毛根の球部に触れたり動かしたりせずに、毛根部分を下図のように検査用紙(資料C)の灰色のエリアに置いてください。
-
これを10本になるまで繰り返してください。
検査は、毛の根元に透明でガラスのような物質が付着しているときに最適に行えます。この部分を取り除いたり、触れたりしないようご注意ください。以下の画像を参考にしてください。提供された拡大鏡で毛の状態を確認することができます。
- 検査に使用する毛根サンプルが十分揃ったら、両面テープのシールを剥がし、毛根を固定します。毛根の球部を切り落とさないよう、毛の長い部分を切り揃えてください。
- 検査用紙(資料C)を三つ折りにして、毛根が内側に収まるようにし、個人情報欄が外側にくるようにします。
- 個人情報を記入し、記入済みの検査用紙(資料C)を同封の封筒に入れ、指定の住所へ郵送してください。

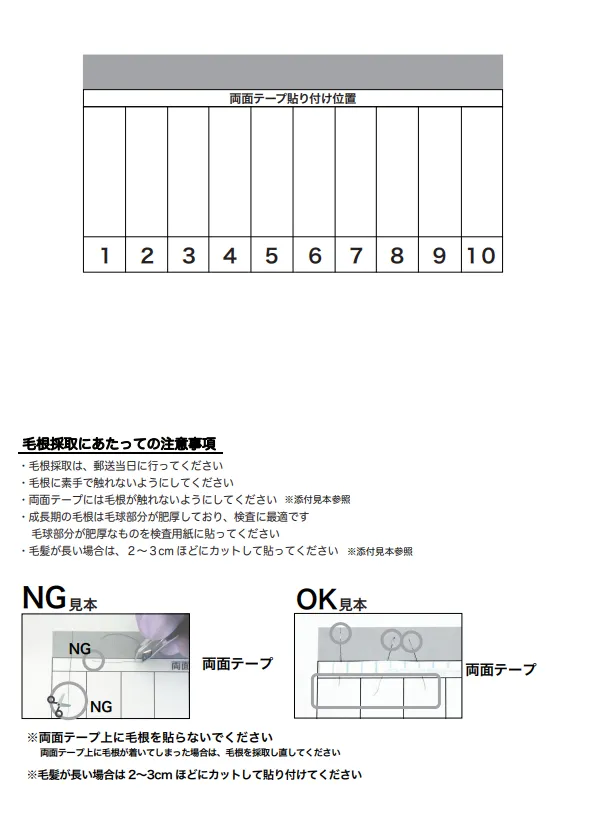
資料 C. 検査用紙

この毛髪は成長期(アナゲン期)にあり、わずかに湾曲したフック状の毛根が特徴です。
また、透明でガラスのような物質も一部確認できます。このような毛髪サンプルは、本検査に理想的です。
硝子膜(グラッシーメンブレン)は、毛根を覆い、真皮の組織と接続する透明で厚みのある結合組織の鞘です。
| 毛根の形態 | ||
|---|---|---|
 |
 |
 |
| 毛包組織がない成長期/退行期の毛球です。 | 少量の毛包組織を伴う成長期の毛球です。 | 多くの透明な毛包組織を伴う成長期の毛球です。 |
| Kawano, K., Yoshida, K., Matsuda, H., Senju, H., & Sato, H. (2006). Hair Root Morphology and STR Typing. Japanese Journal of Forensic Science and Technology, 11(1), 113–124. https://doi.org/10.3408/jafst.11.113 | ||
さらに詳しく知りたい方
AGAとは(さらに詳しく知りたい)
| 7つの主要な病因カテゴリーとその例 | ||||||
|---|---|---|---|---|---|---|
| 休止期脱毛症 Telogen effluvium |
栄養 Nutrition |
薬剤 Medication-induced |
内分泌不均衡 Endocrinal imbalance |
感染症 Infections |
特定疾患 Particular diseases |
悪性腫瘍 Malignancy |
|
|
|
|
|
|
|
AGA(男性型脱毛症)の原因として、ジヒドロテストステロン(DHT)の発現量の増加とアンドロゲン受容体(AR)の感受性の増大が挙げられます。AGAにおける分子経路の概要は以下の通りです。
1. テストステロンの取り込み
テストステロンが細胞内に取り込まれます。
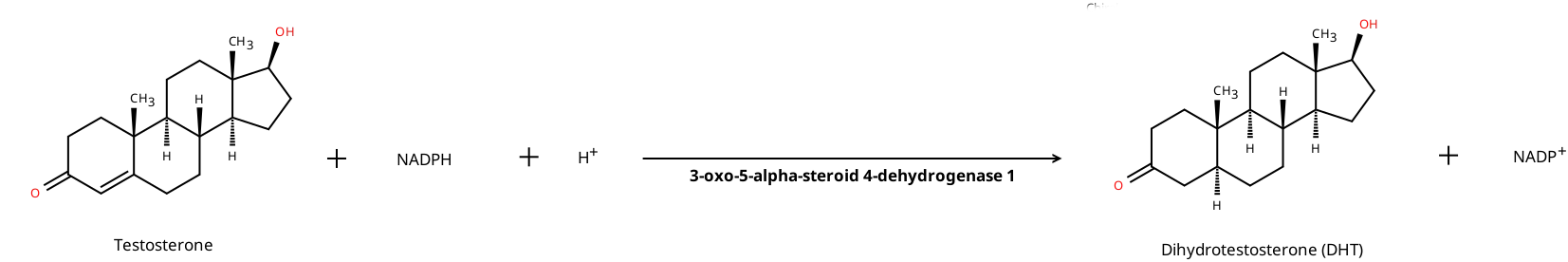
2. DHTへの変換
テストステロンは5α-還元酵素(5α-reductase type 1; 3-oxo-5-alpha-steroid 4-dehydrogenase 1)によって、より強力なアンドロゲンであるジヒドロテストステロン(DHT)に変換されます。
3. DHTとARの結合
DHTはアンドロゲン受容体(AR)に結合し、複合体を形成します。
4. AR-DHT複合体の遺伝子調節
AR-DHT複合体は核内に移行し、遺伝子内のアンドロゲン応答エレメント(ARE)に結合して遺伝子発現を調節します。
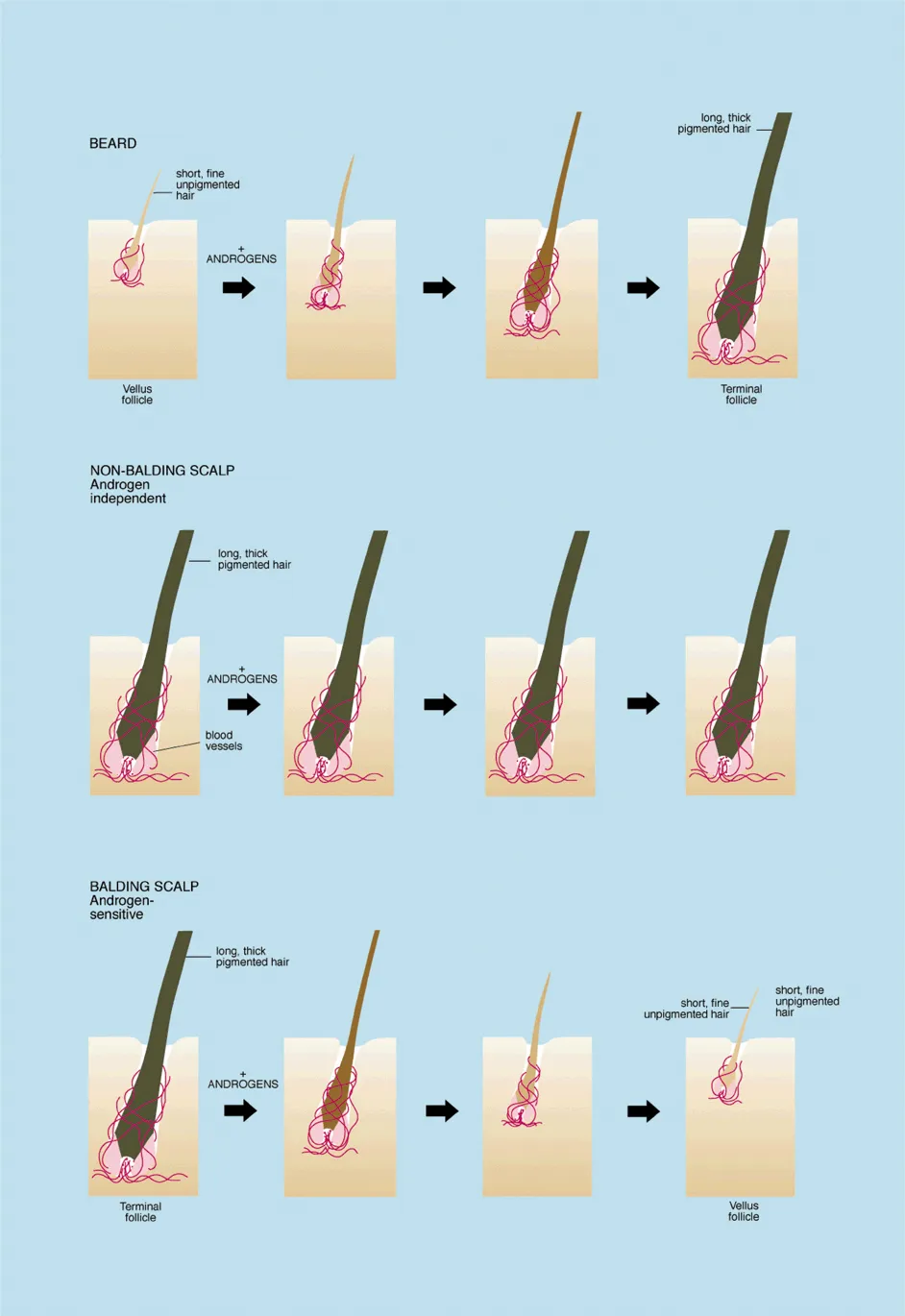
この調節は個人の遺伝的特性によって異なり、毛髪の成長サイクルにおける各段階の期間に影響を与える可能性があります。繰り返される成長期(アナゲン)の短縮と休止期(テロゲン)の延長は、毛包の縮小を引き起こし、最終的には目に見える太く長い終末毛(ターミナルヘア)から、ほとんど見えない小さな産毛(ベルスヘア)へと退行します。これが脱毛として見られる現象です。
『ジーンチェッカー Minoスカルプチェック』の仕組み
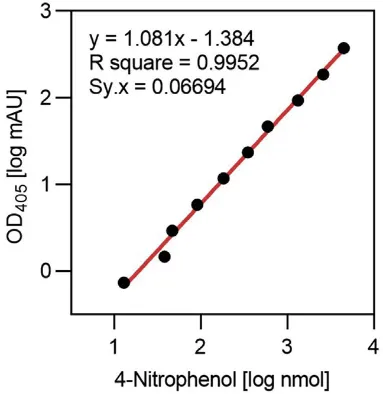
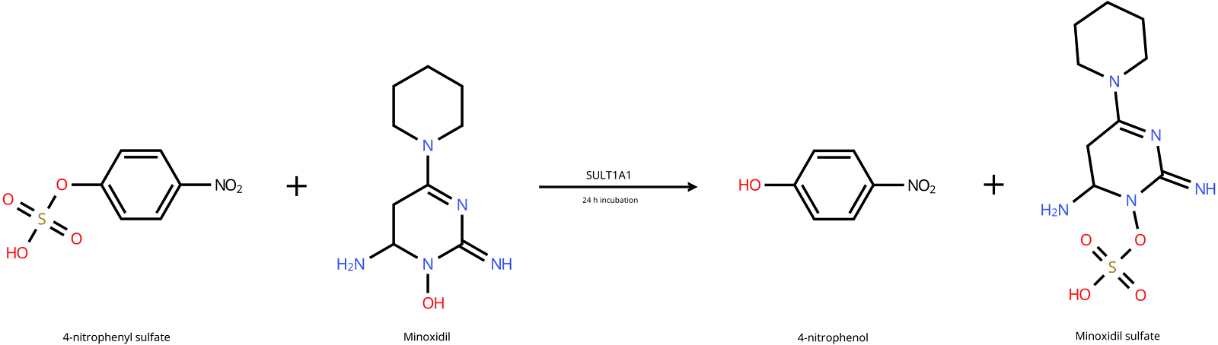
無色の4-ニトロフェニル硫酸は、ミノキシジルの存在下でSULT1A1によって黄色の4-ニトロフェノールに変換されます。採取されたサンプルは一晩インキュベートされ、その後、生成された4-ニトロフェノールが吸収する光をThermo Scientific NanoDrop Eight分光光度計で測定します。
髪の毛の構造
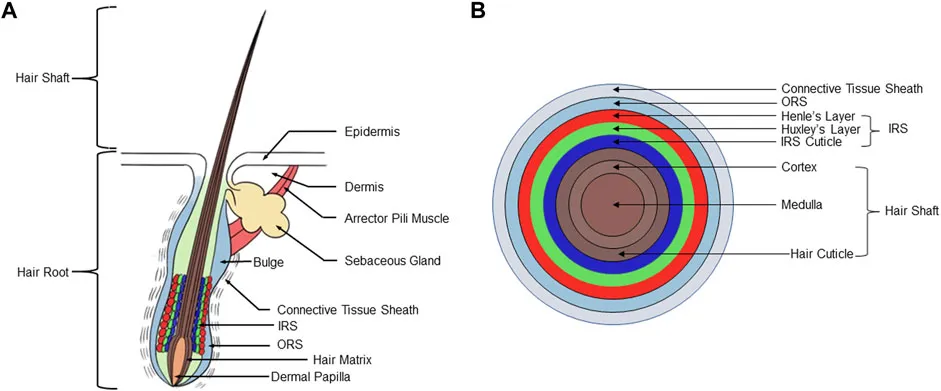
| 英語用語 | 日本語訳 | 簡潔な説明 |
| Hair Shaft | 毛幹 (もうかん) | 皮膚の表面上に出ている毛の部分。 |
| Hair Root | 毛根(もうこん) | 皮膚の下に埋まっている毛の部分。 |
| Epidermis | 表皮 (ひょうひ) | 皮膚の最外層。 |
| Dermis | 真皮(しんぴ) | 表皮の下の層で、結合組織や血管を含む。 |
| Arrector Pili Muscle | 立毛筋(りつもうきん) | 毛を立たせ「鳥肌」を作る小さな筋肉。 |
| Sebaceous Gland | 皮脂腺(ひしせん) | 毛や皮膚を潤す皮脂を分泌する腺。 |
| Bulge | バルジ | 再生能力を持つ幹細胞を含む毛包の一部。 |
| Connective Tissue Sheath | 結合組織鞘(けつごうそしきしょう) | 毛包を包む構造的な支持をする外層。 |
| Inner Root Sheath (IRS) | 内毛根鞘(ないもうこんしょう) | 毛を形作る毛包の内側の層。 |
| Outer Root Sheath (ORS) | 外毛根鞘(がいもうこんしょう) | 毛包の外側の層で、表皮と連続している。 |
| Hair Matrix | 毛母基質(もうぼきしつ) | 毛の成長を司る細胞分裂が活発な部分。 |
| Dermal Papilla | 真皮乳頭(しんぴにゅうとう) | 毛の成長に栄養と信号を送る構造。 |
| Henle's Layer | ヘンレ層(へんれそう) | 内毛根鞘の最外層。 |
| Huxley's Layer | ハクスレー層(はくすれーそう) | 内毛根鞘の中間層。 |
| IRS Cuticle | 内毛根鞘キューティクル | 内毛根鞘の最内層で、毛のキューティクルと連結する。 |
| Cortex | 皮質(ひしつ) | 毛幹の主要部分で、ケラチンとメラニンを含む。 |
| Medulla | 髄質(ずいしつ) | 毛幹の中心部分で、細い毛では欠ける場合がある。 |
| Hair Cuticle | 毛表皮(もうひょうひ) | 毛幹の最外層で、重なり合う細胞が毛を保護する。 |
髪の毛のサイクル
毛包は、成長期(アナゲン期)、退行期(カタゲン期)、休止期(テロゲン期)、脱毛期(エクソゲン期)の4つの主要な段階を含む周期的なプロセスを経ます。このサイクルは、生涯を通じて毛髪を継続的に更新するために不可欠です。
1. 成長期(アナゲン期)
アナゲン期は活発な成長段階であり、毛包が新しい毛幹を生成します。この期間は毛の部位によって異なります。
- 頭髪: 成長期は2〜6年間持続します。
- 眉毛やまつ毛: 成長期は数ヶ月程度です。
この期間中:
- 成長を担う下部構造(インフェリアセグメント)が存在します。
- 真皮乳頭(ダーマルパピラ)が毛包のバルジにある多能性上皮幹細胞に信号を送り、成長を開始します。
- その結果、下部構造が下方に伸長し、真皮乳頭の周囲に球状の構造を形成します。
- 真皮乳頭は球状構造内のマトリックス細胞に刺激を与え、これらの細胞が分裂、分化し、新しい毛幹を上方に向けて成長させます。
2. 退行期(カタゲン期)
カタゲン期は、数週間のみ持続する、毛周期の中で最も短い移行期です。
- 毛包マトリックス内の細胞分裂が停止します。
- 下部構造(インフェリアセグメント)が退縮し、最終的に消失します。
- 真皮乳頭が上方に移動し、バルジ部と接触します。
このプロセスにより、根元が白く硬い「クラブヘア」が形成され、最終的に抜け落ちるまで保持されます。
3. 休止期(テロゲン期)
テロゲン期は、従来は「休止」段階とみなされていましたが、現在では不利な条件下での毛包のエネルギー効率の高い維持段階と定義されています。
- 毛幹は完全に形成されていますが、活発には成長しません。
- 毛包は最小限のエネルギー消費で毛髪を保持しながら維持されます。
- ストレス、外傷、代謝の変化などがテロゲン期を延長させ、毛髪成長サイクルに影響を与える可能性があります。
最近の研究では、テロゲン期の毛包が実際には非常に活発であることが示されています。この段階では、毛包は再生に向けた準備を行っています。
-
テロゲン期は2つの段階に分けられます。
- 初期テロゲン(リフラクトリー期): 刺激に対する応答が低い段階。
- 後期テロゲン(コンピテント期): 毛包が刺激に応じてアナゲン期に再突入する準備が整う段階。
テロゲン期においては、多くの遺伝子が動的に制御されます。この時期、髪の成長は停止していますが、外傷や皮膚の恒常性の乱れに対する迅速な応答環境が確立されます。
4. 脱毛期(エクソゲン期)
エクソゲン期は、テロゲン期の亜段階とみなされることもあります。
- 毛包が古い毛髪を脱落させ、新しい毛髪の成長を可能にします。
毛周期に関する重要な知見
- 出生時、すべての毛包はアナゲン期から開始します。
- 健康な個人では、大部分の毛がアナゲン期にあり、月に約1cm成長します。
- 日常的に約100本の毛髪が自然に抜け落ちますが、シャンプー時にはその数が倍増することがあります。
- アナゲン期には、毛包のバルジ部にある幹細胞が活性化し、毛包の下部を再生させ、新しい毛髪の成長を促します。
ミノキシジルの作用機序
経口ミノキシジルは主に降圧剤として使用され、その効果は硫酸化代謝物によって発揮されます。この代謝物は、ATP感受性内向き整流性カリウムチャネル(Potassium inwardly rectifying; Kir6.x)を活性化することで作用します。カリウムチャネルは非常に選択的で、カリウムイオンのみを通過させ、より小さなナトリウムイオンさえも排除します。ATP感受性カリウムチャネルは細胞代謝やカリウム輸送と密接に関わり、このチャネルが活性化されると、正電荷を帯びたカリウムイオンが細胞外へ流出します。この結果、細胞膜電位が静止膜電位を下回る負の値にシフトする「過分極」が発生します。
過分極によって電位依存性カルシウムチャネルが抑制され、カルシウムイオンの流入が減少します。このカルシウム流入の低下は血管平滑筋を弛緩させ、血管拡張(バソダイレーション)を引き起こし、血圧を低下させます。当初は、ミノキシジルによる毛髪成長促進効果も硫酸化代謝物によるカリウムチャネルの活性化が原因であると考えられていました。
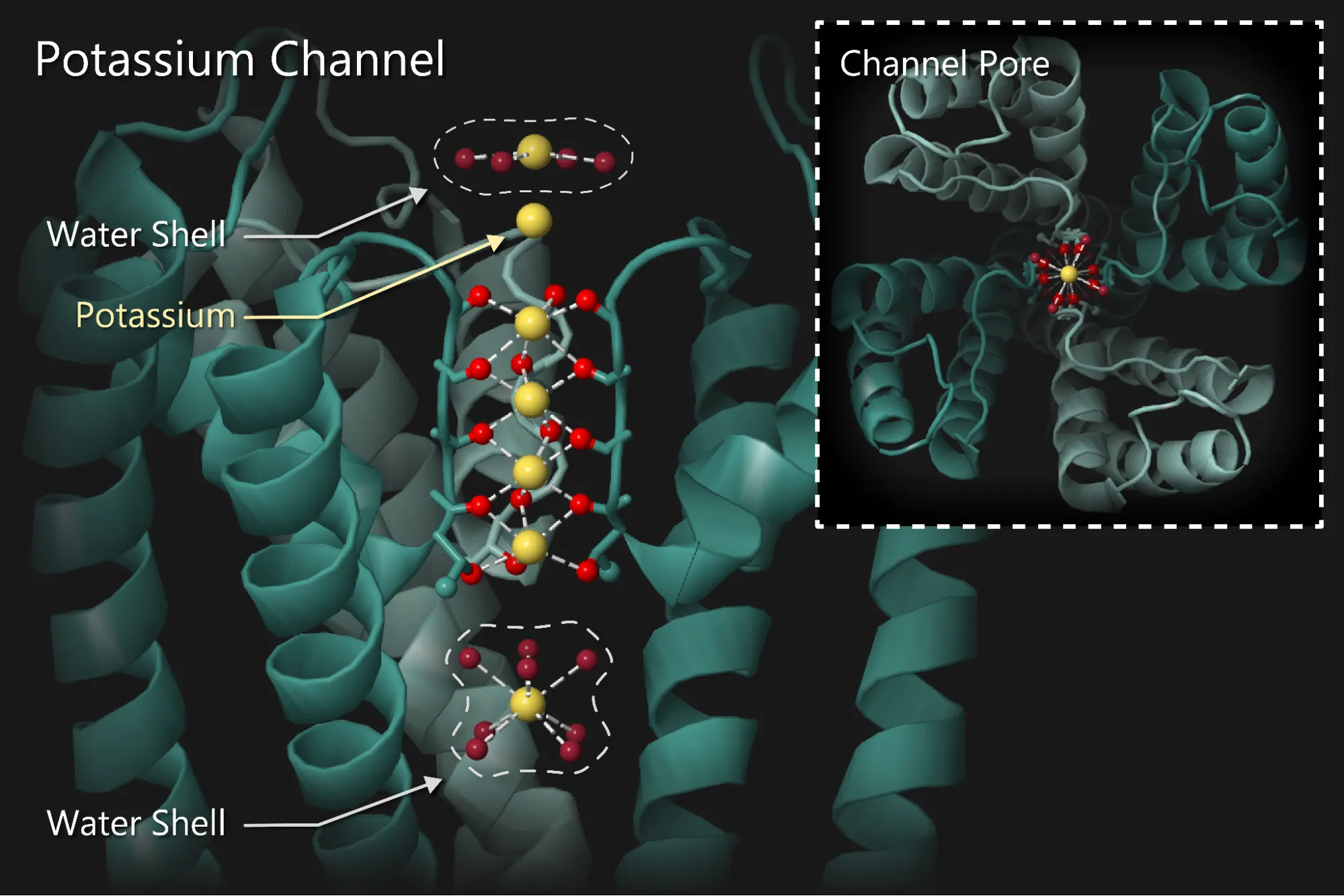
しかし、最近の臓器培養、分子生物学、免疫組織学的解析によって、ヒトの毛包真皮乳頭および真皮鞘にSUR2B-Kir6.1を含むATP感受性カリウムチャネルが存在することが明らかになりました。これらのチャネルはミノキシジルに直接応答し、毛髪成長促進におけるその重要な役割を裏付ける根拠を提供しています。
さらに、局所用ミノキシジルは、血管内皮増殖因子(VEGF)、低酸素誘導因子1α(HIF-1α)、およびプロスタグランジンE2の増加を伴う生化学的変化によって、毛包の休止期(テロゲン期)を短縮し、成長期(アナゲン期)への移行を促進します。また、アナゲン期が延長されるとともに、毛包のサイズが増大することも確認されています。
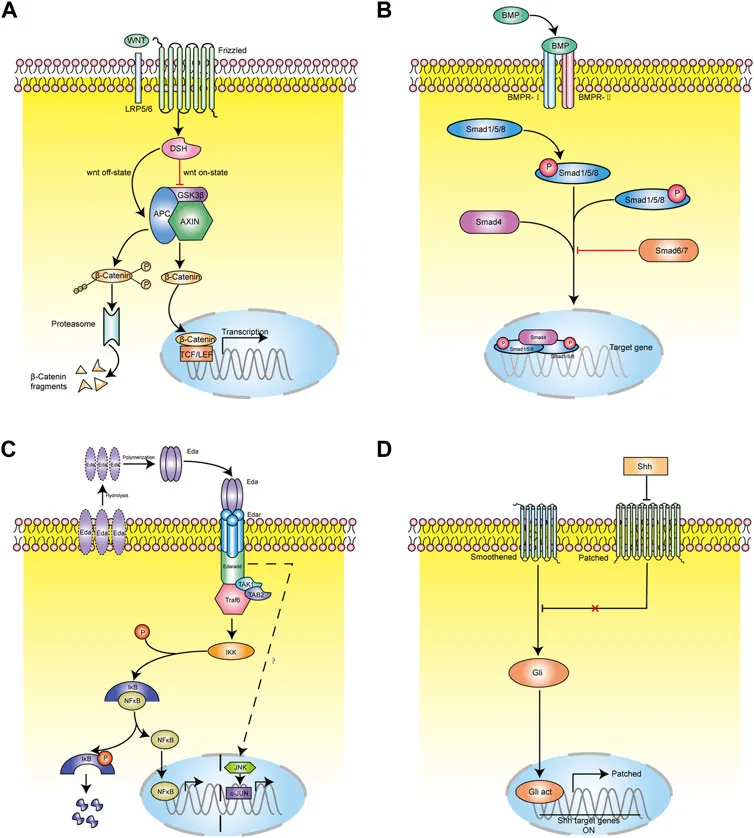
さらに加えて、ミノキシジルは、T細胞を抑制するコンカナバリンA(Con A)を調節することで、免疫調節効果を発揮し、自己免疫性脱毛症の治療に有効である可能性があります。また、その抗炎症作用や抗アンドロゲン作用の可能性、さらには毛包の形態形成およびサイクルの分子制御において重要な役割を果たす4つの主要なシグナル伝達経路(WNT、BMP、EDAR、SHH)への調節的影響についても研究が進められています。
引用文献
- Suchonwanit, P., Thammarucha, S., & Leerunyakul, K. (2019). Minoxidil and its use in hair disorders: a review. "Drug Design, Development and Therapy, 13, 2777–2786.
https://doi.org/10.2147/DDDT.S214907 - Gupta, A. K., Talukder, M., Venkataraman, M., & Bamimore, M. A. (2021). Minoxidil: a comprehensive review. Journal of Dermatological Treatment, 33(4), 1896–1906.
https://doi.org/10.1080/09546634.2021.1945527 - Inui, S., & Itami, S. (2011). Molecular basis of androgenetic alopecia: From androgen to paracrine mediators through dermal papilla. Journal of Dermatological Science, 61(1), 1–6. doi:10.1016/j.jdermsci.2010.10.015
- Geyfman, M., Plikus, M. V., Treffeisen, E., Andersen, B., & Paus, R. (2014). Resting no more: re-defining telogen, the maintenance stage of the hair growth cycle. Biological Reviews, 90(4), 1179–1196. doi:10.1111/brv.12151 Geyfman, M., Plikus, M. V., Treffeisen, E., Andersen, B., & Paus, R. (2014). Resting no more: re-defining telogen, the maintenance stage of the hair growth cycle. Biological Reviews, 90(4), 1179–1196. doi:10.1111/brv.12151
- Nohria, A., Desai, D., Sikora, M., Mandal, S., Shapiro, J., & Lo Sicco, K. (2024). Combating “dread shed”: The impact of overlapping topical and oral minoxidil on temporary hair shedding during oral minoxidil initiation. JAAD International, 15, 220–224.
https://doi.org/10.1016/j.jdin.2024.03.005 - Gupta, A. K., Hall, D. C., Talukder, M., & Bamimore, M. A. (2022). There is a positive dose-dependent association between low-dose oral minoxidil and its efficacy for androgenetic alopecia: Findings from a systematic review with meta-regression analyses. Skin Appendage Disorders, 8(5), 355–361.
https://doi.org/10.1159/000525137 - Gupta, A. K., Talukder, M., & Williams, G. (2022). Comparison of oral minoxidil, finasteride, and dutasteride for treating androgenetic alopecia. Journal of Dermatological Treatment, 33(7), 2946–2962.
https://doi.org/10.1080/09546634.2022.2109567 - De Villez, R. L. (1985). Topical minoxidil therapy in hereditary androgenetic alopecia. Archives of dermatology, 121(2), 197-202.
- Shadi, Z. (2023). Compliance to topical minoxidil and reasons for discontinuation among patients with androgenetic alopecia. Dermatology and Therapy, 13(5), 1157–1169.
https://doi.org/10.1007/s13555-023-00919-x - Goren, A., Sharma, A., Dhurat, R., Shapiro, J., Sinclair, R., Situm, M., Kovacevic, M., Lukinovic Skudar, V., Goldust, M., Lotti, T., & McCoy, J. (2018). Low-dose daily aspirin reduces topical minoxidil efficacy in androgenetic alopecia patients. Dermatologic therapy, 31(6), e12741.
https://doi.org/10.1111/dth.12741 - Limat, A., & Hunziker, T. (1996). Cultivation of keratinocytes from the outer root sheath of human hair follicles. Methods in molecular medicine, 2, 21–31.
https://doi.org/10.1385/0-89603-335-X:21 - Steimle, Alex & Grant, Erica & Desai, Mahesh. (2021). Quantitative assay to detect bacterial glycan-degrading enzyme activities in mouse and human fecal samples. STAR Protocols. 2. 100326. 10.1016/j.xpro.2021.100326.
- Messenger, A. G., & Rundegren, J. (2004). Minoxidil: mechanisms of action on hair growth. British Journal of Dermatology, 150(2), 186–194. doi:10.1111/j.1365-2133.2004.05785.x
- Shorter, K., Farjo, N. P., Picksley, S. M., & Randall, V. A. (2008). Human hair follicles contain two forms of ATP-sensitive potassium channels, only one of which is sensitive to minoxidil. The FASEB Journal, 22(6), 1725–1736. doi:10.1096/fj.07-099424
- Kwack, M. H., Kang, B. M., Kim, M. K., Kim, J. C., & Sung, Y. K. (2011). Minoxidil activates β-catenin pathway in human dermal papilla cells: a possible explanation for its anagen prolongation effect. Journal of dermatological science, 62(3), 154–159.
https://doi.org/10.1016/j.jdermsci.2011.01.013 - Geyfman, M., Plikus, M. V., Treffeisen, E., Andersen, B., & Paus, R. (2015). Resting no more: Re‐defining telogen, the maintenance stage of the hair growth cycle. Biological Reviews, 90(4), 1179–1196.
https://doi.org/10.1111/brv.12151 - Martel JL, Miao JH, Badri T, et al. Anatomy, Hair Follicle. [Updated 2024 Jun 22]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from:https://www.ncbi.nlm.nih.gov/books/NBK470321/
- Goodsell, D. S. (2003). Potassium channels. RCSB Protein Data Bank.
https://doi.org/10.2210/rcsb_pdb/mom_2003_2 - Sharma, A. N., Michelle, L., Juhasz, M., Muller Ramos, P., & Atanaskova Mesinkovska, N. (2020). Low-dose oral minoxidil as treatment for non-scarring alopecia: a systematic review. International journal of dermatology, 59(8), 1013–1019.
https://doi.org/10.1111/ijd.14933







